PRACTICA N° 2
SEPARACION
DE MEZCLAS
I.
OBJETIVO GENERAL
Alcanzar las destrezas
necesarias en el empleo de métodos de separación de mezclas. Específicamente
los métodos de filtración, evaporación y sublimación.
II. OBJETIVOS ESPECÍFICOS
Al finalizar la práctica el
estudiante será capaz:
1.
Definir diferentes métodos de separación de mezclas.
2.
Describir los métodos de filtración, evaporación y
sublimación.
3.
Aplicar cualquiera de los métodos descritos
anteriormente para separar mezclas.
4.
Distinguir e identificar la propiedad y el método
utilizado para separar cada componente.
5.
Calcular el porcentaje de cada uno de los componentes
separados de la mezcla, así como el rendimiento porcentual del proceso de
separación.
MARCO TEORICO
La química es definida por
muchos autores como la ciencia que estudia la composición de la materia y los
cambios que experimenta. La materia es todo aquello que posee masa y ocupa un
lugar en el espacio, por lo que cada cosa del universo tiene una relación
“Química”.
La materia puede existir en
tres estados físicos diferentes: sólido, líquido y gaseoso. Dependiendo de las
características especificas del tipo de material, estos estados se pueden
intercambiar entre ellos, por aumento o descenso de temperatura (Figura 12),
sin que cambie la composición química de la sustancia.
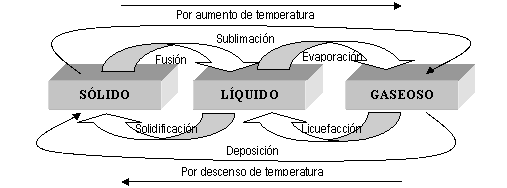
FIG.12. Cambio físico en los estados de la materia
Como se puede observar en el esquema de la figura
13, una clasificación de la materia comprende las mezclas y sustancias puras.
La separación de mezclas es un problema que se confronta constantemente en el
laboratorio, para su resolución se ha desarrollado una amplia variedad de
operaciones o métodos, que permite el aislamiento y purificación de los
distintos componentes.
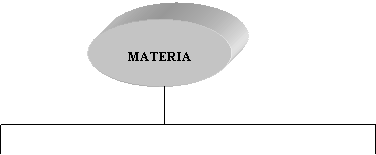
![]()
FIG. 13. Clasificación de la
materia.
La mezcla
homogénea es aquella donde su composición y propiedades son uniformes, aspecto
que no se cumple en las heterogéneas y en las cuales se puede observar los
componentes de la mezcla a simple vista. Una mezcla puede estar constituida por
dos o más componentes, donde cada uno conserva sus propiedades características
que lo distinguen y se pueden separar
por medios físicos sin cambiar la identidad de dichos componentes.
Las propiedades
de la materia pueden ser físicas y químicas; las primeras son cualidades que
incluyen el color, olor, sabor, la solubilidad, la densidad, la dureza, el punto de ebullición, el punto de fusión,
etc. Las propiedades químicas son observadas sólo cuando la materia sufre un
cambio en su composición.
Pocas veces se encuentran sustancias puras en la
naturaleza, sin embargo, se han ideado muchos métodos y técnicas de purificación,
para separar las sustancias de las mezclas de origen. Los métodos de separación
se basan principalmente en diferencias entre las propiedades físicas de los
componentes de la mezcla. Entre los métodos más utilizados se encuentran:
·
Filtración: Consiste en
retener partículas sólidas por medio de una barrera, la cual puede consistir de
mallas, fibras, material poroso o relleno sólido.
·
Destilación: El método consiste
en separar los componentes (líquidos) de la mezcla basándose en las diferencias
de los puntos de ebullición de dichos componentes.
·
Evaporación: consiste en
separar los componentes más volátiles. El aplicar calor o una corriente de aire
seco acelera el proceso.
·
Cristalización: Método de
separación de sólidos en el que una muestra se disuelve en un disolvente
caliente, se filtra y se enfría para inducir la cristalización del sólido
purificado.
·
Sublimación: Una sustancia sólida pasa directamente a gaseosa, sin
ninguna etapa intermedia en estado líquido. En
·
Decantación: Consiste en
separar componentes que contienen diferentes fases (por ejemplo arena y agua)
siempre y cuando exista una diferencia significativa entre las densidades de
las fases.
PARTE EXPERIMENTAL
(Figura 14)
![]()
![]()
![]()

Se
va a separar tres componentes (ácido salicílico, arena y cloruro de sodio) de
una mezcla, utilizando métodos de filtración, evaporación y sublimación, deberá
distinguir e identificar las propiedades y métodos utilizados, para cada componente con ayuda de
la tabla de propiedades (Tabla 13) y luego calcular la composición de la mezcla
y el rendimiento porcentual del proceso de separación.
1.
Pese en la base de una cápsula de
Petri,
2.
Tape con un papel de filtro (N°1), y con
la tapa de la cápsula (previamente pesados).
3.
Coloque la mezcla sobre una plancha
de calentamiento con una rejilla, a temperatura muy baja, posición LOW en la
plancha (aprox.
4.
Retire el vaso, baje la cápsula de la
plancha sin destaparla y deje enfriar.
5.
Levante cuidadosamente la tapa junto con
el papel, inviértalos y una vez alcanzada la temperatura ambiente, pese.
6.
Tome la mezcla restante de la base de
la cápsula y agréguela en un beaker de 50 mL, adicione 20 mL de agua destilada y
agite con una varilla de vidrio. Caliente hasta ebullición y filtre sobre un
papel de filtro previamente pesado (N°2).
7.
Recoja el filtrado en un vaso de 250
mL previamente pesado.
8.
Evapore cuidadosamente el agua en el
beaker hasta sequedad, usando un vidrio reloj, previamente pesado, como tapa. Deje
enfriar y pese todo el conjunto.
9.
Seque en una estufa a

FIG. 14. Dibujo esquemático del procedimiento
experimental.
TABLA 13. Propiedades
físicas de los componentes de la mezcla.
|
Sustancia |
Solubilidad |
Pto fusión |
Apariencia
Física. |
|
Arena |
Insoluble en agua y alcohol |
---- |
Gránulos de varios tamaños |
|
Cloruro de Sodio |
1g disuelve en 2,8 ml de agua fría y en 2,6 mL de agua caliente. |
|
Cristales blancos
higroscópico |
|
Ácido Salicílico |
A 100 ml de agua |
sublima por arriba de 50- |
Polvo cristalino incoloro o cristales en forma de
aguja. |
DATOS EXPERIMENTALES
Masa
de la mezcla………………………………………………………..
|
|
Masa
de la tapa de la cápsula…………………………………………….
|
|
Masa
del papel de filtro N°1……………………………………………..
|
|
Masa
del papel de filtro N°2……………………………………………..
|
|
Masa de tapa de la cápsula + papel de filtro N°1 +
componente 1……….
|
|
Masa
del papel de filtro N°2 + componente 2……………………………
|
|
Masa
del beaker de 250 ml……………………………………………….
|
|
Masa
del vidrio de reloj (tapa del beaker de 250 mL)……………………
|
|
Masa
del beaker + vidrio de reloj + componente 3………………………
|
|
RESULTADOS
TABLA 14.
Resultados obtenidos durante el proceso de separación.
Componente
|
Masa (g) |
Método
de separación
|
Propiedad
utilizada
|
Porcentaje del componente en la mezcla |
Sustancia |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
Mezcla recuperada |
|
-- |
-- |
|
-- |
Rendimiento porcentual = Masa total recuperado x 100 (5)
Masa original de la
mezcla
CUESTIONARIO
1. ¿Qué son estados de
la materia y en qué se distinguen unos de otros?
2. Se mezclan
pequeñas limaduras de hierro con arena ¿Se trata de una mezcla homogénea o
heterogénea?. Sugiera una forma de separarlos.
3. En cada caso, describa la
propiedad subrayada como física o química.
a)
El color normal del elemento bromo es rojo –
anaranjado
b)
El sodio metálico se transforma en hidróxido de sodio en presencia de agua.
c)
La dinamita puede hacer explosión.
d)
El aluminio
metálico, funde a
4. En cada caso,
describa el cambio como químico o físico. Explique su decisión.
a)
Una taza de blanqueador casero cambia el color de su
camiseta de púrpura a rosado.
b)
Los combustibles del trasbordador espacial (hidrógeno
y oxígeno) se combinan para dar agua y proporcionar la energía que impulsa el
trasbordador hacia el espacio.
c)
Un cubo de hielo se derrite en un vaso de limonada.
BIBLIOGRAFIA
1.
CHANG, R y COLLEGE, W. Química. Séptima edición. McGraw-Hill, México, 2002.
2.
DAUB, W y SEESE, W. Química. Séptima edición. Prentice Hall, México, 1996.
3.
BRICEÑO, C y CÁCERES, L. Química. Primera edición. Editorial Educativa, Bogotá-Colombia, 1994.
4. PRETRUCCI, HARWOOD, y HERRING, G. Química General. Octava edición.
Prentice Hall, Madrid, 2003.
5.
MOORE, KOTZ, STANITSKI, JOESTEN y WOOD. El Mundo de
6.
http://www.ur.mx/cursos/diya/quimica/jescobed/separa.htm
<<Regresar<< Principal >>Siguiente>>